Ocorrência de Staphylococcus spp. resistente à meticilina em otite externa canina
Evaluation of the concordance of the antimicrobial dispensation in relation to the microorganisms isolated in cultures of a hospital in the middle-west of Santa Catarina State
Leonardo Cesar Andriola Carvalho1
Thiago Andre Cidral2
Maria Celeste Nunes de Melo3
Wagnner José Nascimento Porto4
Renato Motta Neto3
1Discente do curso de Mestrado em Ciências Biológicas – Universidade Federal do Rio Grande do Norte (UFRN). Natal-RN, Brasil.
2Discente do curso de Mestrado em Biologia Parasitária – Universidade Federal do Rio Grande do Norte (UFRN). Natal-RN, Brasil.
3Professor (a) de Microbiologia – Universidade Federal do Rio Grande do Norte (UFRN). Natal-RN, Brasil.
4Professor de Parasitologia Veterinária – Universidade Federal de Alagoas (UFAL). Maceió-AL, Brasil.
Instituição: Universidade Federal do Rio Grande do Norte (UFRN). Natal-RN, Brasil.
Recebido em 07/08/2019
Artigo aprovado em 12/12/2019
DOI: 10.21877/2448-3877.201900891
INTRODUÇÃO
Dentre as patologias auditivas caninas, a otite externa apresenta-se como uma das mais importantes, representando de 8% a 15% dos casos atendidos na rotina clínica veterinária brasileira.(1) A otite externa é uma afecção inflamatória que acomete o canal auditivo externo, sendo considerada uma das enfermidades mais comuns em cães. Acredita-se que a otopatia ocorra em função das características anatômicas da orelha na espécie canina e apresenta-se muitas vezes como um desafio diagnóstico e terapêutico para o clínico.(2)
Nos últimos anos tem sido reportado que a resistência bacteriana aos agentes antimicrobianos em isolados obtidos de secreções auriculares caninas vem aumentando.(1) Portanto, a cultura bacteriológica e os testes de susceptibilidade aos agentes antimicrobianos são de grande importância para o sucesso do tratamento, bem como para prevenir a seleção de cepas multirresistentes.(3)
A redução da susceptibilidade a antibióticos, entre as várias espécies bacterianas, representa um problema de saúde pública mundial, uma vez que o surgimento de novos recursos terapêuticos não acompanha a evolução dos mecanismos de resistência bacterianos.(4) Em se tratando da meticilina, essa diminuição pode ocorrer tanto em Staphylococcus spp. coagulase positiva (SCP) quanto em Staphylococcus spp. coagulase negativa (SCN)(5) pela modificação das proteínas ligantes de penicilina sintetizadas pelo gene mecA, que torna as cepas bacterianas resistentes aos antibióticos betalactâmicos.(4)
O fenômeno da resistência aos antimicrobianos apresentado pelos Staphylococcus spp. em animais tem sido considerado um problema crescente em medicina veterinária.(5) O SMR tem sido diagnosticado como um agente etiológico de potencial zoonótico, sugerindo que animais de companhia e de produção podem servir como reservatórios deste microrganismo, ocasionando infecções em humanos.(4)
Considerando a elevada frequência de atendimentos de cães com otite externa bacteriana nas clínicas veterinárias, o presente estudo teve por objetivo verificar a ocorrência de SMR e seu perfil de resistência aos antibacterianos em pacientes ambulatoriais e de internamento diagnosticados com a otopatia, visando o aprimoramento na conduta clínica do médico veterinário.
MATERIAL E MÉTODOS
Tratou-se de um estudo transversal descritivo e de abordagem quantitativa. Entre junho de 2015 e abril de 2016 foram coletadas 140 amostras de secreção otológica de pacientes caninos de ambos os sexos sem distinção de raça e idade, diagnosticados com otite externa, recrutados por demanda espontânea através de atendimento clínico em um hospital veterinário privado na cidade de Natal (RN) para realização de bacterioscopia, cultura bacteriana e antibiograma. Este trabalho limitou-se apenas ao estudo bacteriológico.
Como critério de inclusão, os cães otopatas deveriam apresentar pelo menos dois sinais indicativos de otite externa: prurido, estenose do conduto auricular, eritema, descamação, lignificação, alterações na quantidade, cor e odor da secreção auricular, dor à palpação, meneio cefálico.
A coleta do espécime foi realizada com auxílio de swabs individuais estéreis dos pavilhões auriculares e meato acústico bilateralmente, acondicionados em meio de transporte Cary Blair (HiMedia®) e encaminhados ao Laboratório de Micobactérias da UFRN para processamento em até 24 horas após a coleta. Para isolamento bacteriano, as amostras foram cultivadas nos meios de ágar suplementado com 5% de sangue de carneiro desfibrinado (HiMedia®) e ágar MacConkey (HiMedia®) e então incubadas a 35°C por 24 horas em estufa bacteriológica.(6) A identificação ocorreu através da coloração de Gram e provas bioquímicas.(6,7,8) Posteriormente, todos os isolados foram submetidos ao teste de susceptibilidade aos antimicrobianos: penicilina (PEN, 10U), cefoxitina (CFO, 30 µg), gentamicina (GEN, 10 µg), sulfametoxazol-trimetoprima (SUT, 1,25/23,75 µg), levofloxacina (LEV, 5 µg), eritromicina (ERI, 15 µg), cloranfenicol (CLO, 30 µg), clindamicina (CLI, 2 µg), rifampicina (RIF, 5 µg), tetraciclina (TET, 30 µg) e linezolida (LNZ, 30 µg) pelo método de difusão em ágar Müeller-Hinton (HiMedia®) com discos, incluindo o teste-D.(9,10)
As cepas resistentes à cefoxitina detectadas no antibiograma (ágar disco difusão) foram triadas para o teste Met-25. Neste teste, as amostras foram transferidas para tubos contendo caldo Brain Heart Infusion (BHI – HiMedia®) e então deixadas em estufa bacteriológica a 37°C por 24 horas sob agitação para posterior semeio em placas contendo 25 µg de meticilina.(11) Confirmando crescimento bacteriano (positividade do Met-25), era então realizada PCR a fim de confirmar presença do gene mecA.
A extração do DNA cromossomal foi realizada pela técnica da lise térmica e o gene mecA foi detectado utilizando-se os primers mecA senso 5′-TCCAGATTACAACTTCAC CAGG-3′ e mecA antissenso 5′-CCACTTCATATCTT GTAACG-3′ amplificando 192 pares de bases na região V do domínio 23S do gene do RNA ribossômico do SCCmec, ambos na concentração de 0,5 µM. A reação foi preparada pela adição de 25 unidades/mL de Taq DNA polimerase, 200 µL dATP, 200 µL dCTP, 200 µL dGTP, 200 µL dTTP, 3 mM de MgCl2 em termociclador Biorad® (São Paulo, Brasil) T- 100 Thermal Cycler utilizando Master Mix (Promega®, São Paulo, Brasil).(12)
Os ciclos da reação foram: um ciclo de 94ºC por cinco minutos para desnaturação inicial do DNA alvo, seguido de 35 ciclos de trinta segundos a 94ºC, trinta segundos a 52ºC, um minuto e trinta segundos a 72ºC, e um passo de extensão final do primer a 72ºC por cinco minutos. Os produtos da PCR foram submetidos a eletroforese em gel de agarose a 1% com tampão TBE (Tris- Ácido-Bórico-EDTA) 0,5 x durante cinquenta minutos a 100V. Na sequência da eletroforese, os géis foram corados com brometo de etídio a 10 µL por dez minutos e visualizados em transiluminador UV e fotografados. Como controle positivo foi utilizada a cepa BMB 9393 e como controle negativo da reação, água livre de nuclease.(12)
Nos espécimes portadores do mecA foi determinada a concentração bactericida mínima ao gluconato de clorexidina, ou seja, a menor concentração da solução de clorexidina capaz de impedir o crescimento estafilocócico; 100 µL de BHI (concentração dupla) foram distribuídos em placa de microtitulação de 96 poços, em todos os poços. Foram adicionados à primeira coluna 100 µL de solução de gluconato de clorexidina a 1%; depois, foram homogeneizados e retirados 100 µL de cada poço da coluna 1 (da linha A até a linha H) para a coluna 2. Esse mesmo procedimento se repetiu sucessivamente por todas as colunas (até a coluna 12), obtendo-se, então, as concentrações da solução de clorexidina (1.000.000 µg/mL-1 – 1%, a 7.812,5 µg/mL-1 – 0,0078 12%).(13)
Em seguida, adicionou-se uma alíquota de 10 µL do inóculo bacteriano em cada poço da microplaca e incubou-se a 35ºC por 24 horas. Após esse tempo, 10 µL de cada poço foram retirados e inoculados na superfície do ágar Müeller-Hinton (Himedia®) com as placas devidamente identificadas para cada concentração testada. As placas foram então incubadas a 36ºC e, após 24 horas, foi observado se houve ou não crescimento bacteriano, e, se houve, em qual concentração.(13)
Todos os dados da pesquisa foram agrupados em tabelas. As análises estatísticas para as associações entre as variáveis foram realizadas com base no Teste Exato de Fisher (software estatístico R) com nível de significância a=0,05. O valor de p menor que 0,05 foi considerado estatisticamente significante. O modelo estatístico foi proposto pelo Laboratório de Estatística Aplicada da UFRN.
Ética
O presente estudo foi aprovado pela Comissão de Ética no Uso de Animais da Universidade Federal do Rio Grande do Norte (CEUA/UFRN) sob o protocolo nº 027/2015.
RESULTADOS
Nos isolados bacterianos dos 140 cães participantes do estudo percebeu-se que o gênero Staphylococcus foi presente em 122 amostras (82 SCN – 67,21%; 40 SCP – 32,79%). Destes, 14 cepas foram SMR (11,47%), sendo estas mesmas também positivas no Met-25 e apresentaram o gene mecA (Figura 1). Das cepas resistentes à Meticilina, cinco foram teste-D positivo (Figura 2).
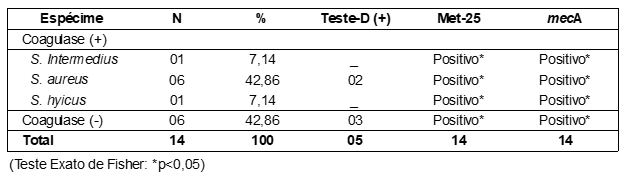
Todos os SMR apresentaram perfil de multirresistência, mais notadamente frente às penicilinas (100%), cefamicinas (100%), sulfametoxazol + trimetoprim (78,57%), tetraciclinas (78,57%) e lincosamidas (64,29%). Dentre os antimicrobianos testados, os que apresentaram melhor sensibilidade in vitro foram: linezolida (100%), cloranfenicol (100%), rifampicina (100%) e gentamicina (78,57%).
Houve significância estatística pelo Teste Exato de Fisher (software estatístico R – p<0,05) entre as variáveis “resistência à cefoxitina” no antibiograma, “Met-25 positivo” e “mecA positivo” nas 14 amostras de SMR. A CBM ao gluconato de clorexidina foi de 500.000 µg/mL (0,5%) para os SCP e 62.500 µg/mL (0,0625%) para os SCN (Figura 3).
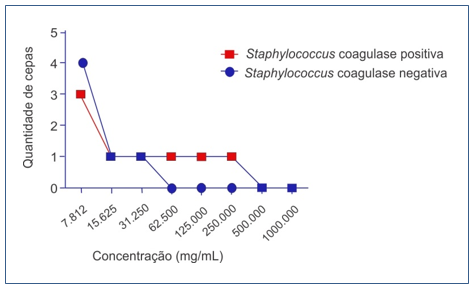
Figura 3. CBM para o gluconato de clorexidina das cepas SMR. Crescimento bacteriano frente às concentrações de Clorexidina testadas.
DISCUSSÃO
Tunon et al.(14) discutiram que muitas vezes a otite é um sintoma de outras doenças e não um diagnóstico definitivo, podendo estar presente em cerca de até 25% dos cães atendidos em uma clínica veterinária por outro motivo. Esta pode ser a provável explicação para a otopatia ter sido tão detectada nos pacientes ambulatoriais.
O fato de os estafilococos serem comensais da pele e contaminantes ambientais pode ter favorecido sua ocorrência no presente estudo.(2) Além disso, a presença de diversos fatores de agressão e a produção da enzima coagulase estão correlacionadas à patogenicidade do gênero Staphylococccus, conferindo maior capacidade de determinar infecções, mesmo sobre pouca influência de fatores predisponentes.(1)
Das cinco cepas que foram teste-D positivo, três eram de SCN e este dado é alarmante, pois além de diminuir o arsenal terapêutico para o clínico veterinário, possibilita que uma bactéria comensal do microbioma adquira alto perfil de resistência, podendo, inclusive, transmiti-lo para outras bactérias, causando um agravo maior à saúde do animal acometido.(10) Tunon et al.(14) comentaram que os SCN são considerados patógenos emergentes. Eles podem causar infecções oportunistas em indivíduos que apresentem lesões ou façam uso de dispositivos médicos invasivos.(15)
Acredita-se que o uso indiscriminado de antimicrobianos tópicos pelos proprietários dos cães possa estar induzindo o processo de resistência bacteriana, uma vez que estes proprietários frequentemente ignoram preceitos de limpeza, frequência regular de aplicações e duração mínima do tratamento.(16) Sfaciotte et al.(17) discutiram que a ocorrência de microrganismos multirresistentes na medicina veterinária se dá pelo uso de antibacterianos como “promotores do crescimento” em aves e suínos, na profilaxia de doenças específicas, além do uso incorreto e no apelo comercial de certos fármacos.
Papich(18) apontou que normalmente os estafilococos resistentes à meticilina também são resistentes a diversas outras classes de antibacterianos não b-lactâmicos, como macrolídeos, sulfonamidas e tetraciclinas, dados semelhantes aos encontrados no presente estudo. Lilenbaum et al.(19) verificaram que as melhores drogas contra infecções otológicas por Staphylococcus spp. foram rifampicina e gentamicina. Oliveira et al.(20) acrescentaram ainda as quinolonas, os aminoglicosídeos e o cloranfenicol como antimicrobianos frequentemente escolhidos para o tratamento de otites caninas devido à sua eficiência contra bactérias Gram-positivas e bactérias Gram-negativas. Além destes, Cruz et al.(21) indicaram as cefalosporinas e inibidores de b-lactamases para tratamento da otite externa canina, corroborando com este estudo.
Cepas de SMR associadas com um perfil de multirresistência podem ser preocupantes em função da sua implicação na Saúde Pública, mostrando que os cães podem ser reservatórios e fontes de transmissão em potencial de patógenos multirresistentes para o homem pelo contato físico direto que ocorre com alta frequência devido à percepção humana de que os animais de companhia são membros da família e pelo fato de ambas as espécies serem medicadas com as mesmas classes de antibacterianos. Por isso, investir na educação dos tutores, em noções sobre posse responsável dos animais, além de cuidados de limpeza, retirada de pelos e da umidade do conduto auditivo são imprescindíveis e aliadas na profilaxia e no controle da otite em cães e na consequente seleção de bactérias multirresistentes.(22)
Mimica e Mendes(23) demonstraram que nos últimos anos diversos autores conferiram boa acurácia do teste de disco-difusão com cefoxitina para o diagnóstico rotineiro da resistência à oxacilina em estafilococos. Pela relevância estatística que houve (p<0,05) entre os testes de resistência fenotípicos e genotípico para os Staphylococcus spp. deste estudo, constatou-se que ambos são bons preditores do caráter de multirresistência estafilocócica na medicina veterinária e conclui-se a relevância do Met-25 no diagnóstico clínico laboratorial. O teste fenotípico do Met-25 acaba se tornando um método mais simples, eficiente e de baixo custo quando comparado aos de biologia molecular (PCR) quando se deseja realizar estudos de vigilância.(3)
Pegoraro et al.(24) destacaram que, para a ação degermante tanto de microrganismos Gram-positivos quanto Gram-negativos, o gluconato de clorexidina é amplamente utilizado na área da saúde pelo seu efeito antisséptico. É uma droga bem aceita no tratamento de afecções dermatológicas, de fácil acesso, baixo custo e provável baixa toxicidade em função da baixa CBM encontrada no presente estudo.
Camilo et al.(25) discutiram que a utilização do gluconato de clorexidina para lavagens otológicas em cães que apresentam bactérias multirresistentes em quadros clínicos de otites crônicas foi benéfica, servindo como um auxiliar terapêutico no tratamento da otopatia, porém, deve-se primeiro confirmar a integridade da membrana timpânica do paciente.
CONCLUSÕES
A otite externa canina é uma enfermidade relevante na clínica veterinária e o seu envolvimento com bactérias multirresistentes é reportado. Para evitar a disseminação dessas bactérias é de suma importância se estabelecer o perfil de susceptibilidade aos agentes antibacterianos, além dos testes de resistência, visando um tratamento direcionado e eficaz, obtendo-se assim o sucesso desejado.
Apesar da baixa ocorrência de Staphylococcus spp. resistentes à meticilina neste estudo, existe a necessidade de um monitoramento constante em cepas isoladas de animais domésticos em virtude da transmissão de genes de multirresistência e do potencial zoonótico que estes podem causar.
Agradecimentos
Os autores agradecem à equipe técnica do Laboratório de Ensino em Microbiologia (LEM-UFRN) e aos Laboratório de Bacteriologia Médica (LabMed-UFRN) e Laboratório de Micobactérias (LabMic-UFRN) pela assistência na execução deste estudo.
Abstract
Objective: The objective of this study is to outline the resistance profile of methicillin-resistant Staphylococcus spp. (MRS) isolates from outpatient and inpatient care dogs diagnosed with otopathy. Methods: Isolation and bacteriological identification through biochemical tests and antibacterial susceptibility testing. Detection of mecA gene by PCR and determination of minimum bactericidal concentration (CBM) to chlorhexidine gluconate. Results: 140 samples were collected and from these 122 was Staphylococcus spp. (49.4%). Of all bacterial isolates 14 (11.47%) were MRS (eight coagulase positive and six coagulase negative) with mecA gene. The minimum bactericidal concentration to chlorhexidine guconate was 500,000 mg/mL (0.5%) for coagulase positive Staphylococcus spp. and 62,500 mg/mL (0.0625%) for coagulase negative. Five MRS were positive for D-test. The MRS were 100% sensitive to linezolide, chloramphenicol and rifampicin. Conclusion: Despite the low frequency of multiressitance found, there is a need for more effective monitoring in strains isolated from domestic animals to guarantee successful treatment and control of bacterial resistance in canine otological infections.
Keywords
Dogs; otitis externa; Staphylococcus spp.; methicillin resistance
REFERÊNCIAS
- Plischke KM, Pereira AV. Etiopatogenia, diagnóstico e tratamento da otite externa canina: revisão. Medvep Derm. 2012;2(4):188-95.
- Moura ESR, Fonseca ZAAS, Feijó FMC, Filgueira KD, Silva JBA. Isolamento e identificação de microrganismos causadores de otites em cães. Pubvet [periódicos na internet]. 2010 [acesso em 04 de nov 2016]; 4(2). Disponível em: http://www.pubvet. com.br/artigo/1599/isolamento-e-identificaccedilatildeo-de-microrganismos-causadores-de-otites-em-catildees.
- Pemma B, Varges RG, Medeiros L dos S, Martins GM de S, Martins RR, Lilenbaum W. Editora Guará, São Paulo, Brazil, Clínica Veterinária, 2011, Vol.16, Nº 90, pp. 82-88.
- Pantosti A. Methicillin-resistant Staphylococcus aureus associated with animals and its relevance to human health. Front Microbiol. 2012 Apr 9;3:127. https://doi.org/10.3389/fmicb.2012.00127.
- Kluytmans JÁ. Methicillin-resistant Staphylococccus aureus in food products: cause for concern or case for complacency? Clin Microbiol Infect. 2010 Jan;16(1):11-5. doi: 10.1111/j.1469-0691. 2009.03110.x.
- Murray PR, Baron EJ, Pfaller MA, Tenover FC, Yolken RH. Manual of clinical microbiology. 7ª ed. Washington: ASMPress; 2009.
- Brito MVP, Campos GMM, Brito JRF. Esquema simplificado para identificação de estafilococos coagulase-positivos isolados de mastite bovina. Cienc. Rural, Santa Maria, v. 32, n. 1, p.79-82, Feb. 2002. Acessível em http://dx.doi.org/10.1590/S0103-84782002000100014
- Quinn PJ, Markey BK, Carter ME, Donnelly WJ, Leonard FC. Microbiologia veterinária e doenças infecciosas. 1ª ed. Porto Alegre: Artmed; 2007.
- Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing. Pennsylvania: NCCLS; 2015.
- Amorim DMR, Person OC, Amaral PJ, Tanaka II. Resistência induzível à clindamicina entre isolados clínicos de Staphylococcus aureus. O Mundo da Saúde 2009; 33:401-405.
- Coelho SMO, Moraes RAM, Soares LC, Pereira IA, Gomes LP, Souza MMS. Mapeamento do perfil de resistência e detecção do gene mecA em Staphylococcus aureus e Staphylococcus intermedius oxacilina-resistentes isolados de espécies humanas e animais. Cienc. Rural. 2007 Jan;(37):195-200.
- Cidral TA, Carvalho MC, Figueiredo AM, de Melo MC. Emergence of methicillin-resistant coagulase-negative Staphylococci resistant to linezolid with rRNA gene C2190T and G2603T mutation. APMIS. 2015 Oct;123(10):867-71. doi: 10.1111/apm. 12426.
- Bona EAM, Pinto FGS, Fruet TK, Jorge TCM, Moura AC. Comparação de métodos para avaliação da atividade antimicrobiana e determinação da concentração inibitória mínima (CIM) de extratos vegetais aquosos e etanólicos. Arq. Inst. Biol. 2014 Fev;81(3):218-25. http://dx.doi.org/10.1590/1808-1657001192012.
- Tunon GIL, Silva EP, Faierstein CC. Isolamento de estafilococos multirresistentes de otites em cães e sua importância para a saúde pública. Bepa. 2008 Out;5(58):4-7.
- Rogers KL, Fey PD, Rupp ME. Coagulase-negative staphylococcal infections. Infect Dis Clin North Am. 2009 Mar;23(1):73-98. doi: 10.1016/j.idc.2008.10.001.
- Hariharan H, Coles M, Poole D, Lund L, Page R. Update on antimicrobial susceptibilities of bacterial isolates from canine and feline otitis externa. Can. Vet. J. 2006 Mar;47(3):253-55.
- Sfaciotte RAP, Coronel LG, Osaki SC, Wosiacki SR. Gram-positive bacterial resistant strains of interest in animal and public health. Semina: Ci. Agrárias. 2015 Jul;36(4):2693-2712.
- Papich MG. Selection of antibiotics for methicillin-resistant Staphylococcus pseudintermedius: time to revisit some old drugs? Vet Dermatol. 2012 Aug;23(4):352-60, e64. doi: 10.1111/j.1365-3164.2011.01030.x.
- Lilenbaum W, Veras M, Blum E, Souza GN. Antimicrobial susceptibility of Staphylococci isolated from otitis externa in dogs. Lett Appl Microbiol. 2000 Jul;31(1):42-5. DOI: 10.1046/j.1472-765x.2000.00759.x.
- Oliveira VB, Ribeiro MG, Almeida ACS, Paes AC, Condas LAZ, Lara GHB, et al. Etiologia, perfil de sensibilidade aos antimicrobianos e aspectos epidemiológicos na otite canina: estudo retrospectivo de 616 casos. Semina: Ci. Agrárias. 2012 Nov; 33(6):2367-74.
- Cruz AR, Paes AC, Siqueira AK. Perfil de sensibilidade de bactérias patogênicas isoladas de cães frente a antimicrobianos. Vet. e Zootec. 2012 Dez;19(4):601-10.
- Lima M, Pedroso KC, Lucas R, Medeiros FRC, Rosa C, Lezan S, et al. Estudo retrospectivo de identificação de bactérias isoladas em otites de cães e seu perfil de susceptibilidade nas cidades: Rio de Janeiro e São Paulo. Medvep Derm. 2012;2(3):100-4.
- Mimica MJ, Mendes CMF. Diagnóstico laboratorial da resistência à oxacilina em Staphylococcus aureus. J. Bras. Patol. Med. Lab. 2007 Dez;43(6):399-406.
- Pegoraro J, Silvestri L, Cara G, Stefenon L, Mozzini CB. Efeitos adversos do gluconato de clorexidina à 0,12%. J Oral Invest. 2015 Nov;3(1):33-7.
- Camilo CCES, Travessos VM, Lima ER. Avaliação terapêutica da otite externa em cães atendidos no hospital veterinário da Universidade Federal Rural de Pernambuco. In: XIII Jornada de Ensino, Pesquisa e Extensão [evento na internet]. 2013 09dez-13dez; Recife, Brasil [acesso em 26 nov 2016]. Disponível em: http://eventosufrpe.com.br/2013/cd/resumos/r0886-1.pdf.
Correspondência
Leonardo Cesar Andriola Carvalho
Universidade Federal do Rio Grande do Norte (UFRN)
Campus Universitário, Lagoa Nova
59078-970 – Natal-RN, Brasil
