Plasma rico em plaquetas: uma revisão sobre seu uso terapêutico
Platelet-rich plasma: a review of its therapeutic use
Pâmela Aparecida da Costa1
Patrícia Santos2
1Curso em andamento – Farmácia. Estagiária na Área de Microbiologia. Universidade do Oeste de Santa Catarina – UNOESC – Campus Videira, SC, Brasil.
2Farmacêutica bioquímica, professora de Farmacologia na Universidade do Oeste de Santa Catarina – UNOESC – Campus Videira, SC e Universidade do Alto Vale do Rio do Peixe – UNIARP – Caçador, SC. Mestre em Farmacologia – Universidade Federal de Santa Catarina – Florianópolis, SC, Brasil.
Instituição: Universidade do Oeste de Santa Catarina – UNOESC – Campus Videira, SC, Brasil.
Artigo recebido em 10/06/2013
Artigo aprovado em 29/01/2016
DOI: 10.21877/2448-3877.201600177
Resumo
O plasma rico em plaquetas (PRP) é uma técnica inovadora e vantajosa que tem apresentado resultados significativos em diversos ramos da medicina. O presente estudo teve como objetivo analisar os usos terapêuticos do PRP, por meio de uma revisão da literatura, de natureza qualitativa, avaliando artigos científicos eletrônicos publicados entre os anos de 2000 e 2013. O PRP autólogo, preparado com o sangue do próprio paciente, é preferido por diminuir a chance de efeitos adversos do tratamento. É um produto orgânico, atóxico e não imunorreativo, tem sido utilizado para acelerar os caminhos da cicatrização da ferida cirúrgica. Tem aplicação em áreas multidisciplinares, mostrando resultados promissores especialmente na regeneração tecidual e na cicatrização, por ser considerado um agente catalisador no processo de reparo. Diversos estudos na literatura demonstram que os fatores de crescimento derivados das plaquetas são os principais responsáveis pela aceleração da regeneração tecidual e outros efeitos terapêuticos do PRP, sendo que se destaca, entre os fatores de crescimento presentes no PRP, o PDGF (Fator de crescimento derivado de plaquetas), considerado iniciador universal da maior parte do processo de cicatrização. O estudo analisado e discutido aborda o elevado potencial do PRP para regeneração tecidual, sendo considerado uma técnica confiável e eficiente.
Palavras-chave
Plasma rico em plaquetas; Fatores de diferenciação de crescimento; Fator de crescimento derivado de plaquetas
INTRODUÇÃO
Apesar de existirem dúvidas no ramo da medicina acerca da obtenção e capacidade de regeneração tecidual do sangue autógeno do paciente, observa-se um grande interesse da comunidade científica em arregimentar informações concretas sobre a utilização do plasma rico em plaquetas para avaliar seus pontos positivos e negativos e determinar a porcentagem de regeneração (estimativa) antes e depois da sua utilização. Desta forma, o presente trabalho será de suma importância para a atualização quanto à abordagem sobre os novos trabalhos datados no período estabelecido.
Desde meados da década de 90, o gel de plaquetas, também denominado plasma autógeno de plaquetas, plasma enriquecido com plaquetas ou, até mesmo, concentrado de plaquetas, tem sido usado nas áreas de cirurgia oral, reconstrutiva oral, bucomaxilofacial e procedimentos de reconstrução para implantodontia, medicina estética, entre outros ramos da medicina, visando acelerar o reparo da ferida cirúrgica e a regeneração óssea.(1,2,3)
O gel de plaquetas surgiu como uma alternativa viável para minimizar as complicações decorrentes do uso da cola de fibrina, procedimento utilizado há mais de sessenta anos.(1) Porém, é valido ressaltar que esta preparação pode conter variações em seu volume e osmolaridade, tendo alguns eletrólitos mais abundantes, como o sódio e o cloreto de bicarbonato. Recentemente, estudos mostram benefícios do plasma rico em plaquetas em diversas áreas da medicina como, por exemplo, no tratamento de problemas musculoesquelético e articular, vantajoso para atletas profissionais, como jogadores de futebol, que precisam da rápida cicatrização para retornar à atividade.(4,5)
A doutrina nacional e estrangeira tem destacado as propriedades regenerativas do PRP, sendo considerado um agente catalisador no processo de reparo tecidual. O processamento do PRP envolve a separação das plaquetas com todas as suas propriedades, podendo, assim, ser considerado uma fonte autógena de fatores de crescimento, pois trata-se de princípio terapêutico inovador, acelerando as etapas de reparo da ferida.(6)
O plasma rico em plaquetas (PRP) é um concentrado de plaquetas obtido a partir do sangue autógeno do paciente.(7,8) As células sanguíneas são constituídas de uma parte líquida passível de obtenção do plasma, originam-se na medula pela hematopoiese e dão origem a diversas linhagens: glóbulos vermelhos, glóbulos brancos e plaquetas.(9)
As plaquetas representam o componente mais importante quando o objetivo é a modulação cicatricial, apresentando propriedades anti-inflamatórias e regenerativas.(10) Todavia, existem outros componentes atuando juntamente com o PRP ou com o plasma pobre em plaquetas (PPP), como os leucócitos e células brancas, que garantem a resistência natural aos fatores que dizem respeito a processos infecciosos ou alérgicos. Por isso a importância destes componentes, sendo que a principal função do nosso organismo é a defesa contra os agentes estranhos.(8) Tanto o PRP quanto o PPP são importantes na possível reconstrução tecidual, pois ambos possuem os fatores de crescimento complexos, podendo determinar diferentes efeitos sobre um mesmo tecido.(1)
Podemos estabelecer alguns procedimentos para a preparação do plasma rico em plaquetas, plasma intermediário em plaquetas e plasma pobre em plaquetas ou rico em fibrinogênio durante a realização da centrifugação, pois o plasma pobre em plaquetas (PPP) contém os eritrócitos, e da crosta do coágulo (plaquetas e leucócitos), que estão presentes, logo na camada posterior, podemos obter o plasma rico em plaquetas.(1,11)
Segundo Balbino,(12) o fator de crescimento derivado de plaquetas (PDGF) foi o primeiro fator de crescimento cuja propriedade quimiotática sobre macrófagos, neutrófilos e fibroblastos foi demonstrada. Sua principal característica é ser um produto atóxico, sendo obtido do próprio paciente, através de processo laboratorial de coleta e posterior preparação, sendo incapaz de gerar imunorreação devido aos componentes descritos acima, que especificam sua devida função.(8)
A preparação do PRP se dá por meio de um procedimento simples, que é a centrifugação do sangue total anticoagulado, sob condições controladas, obtida pela sequestração e concentração por gradiente de densidade. Esta centrifugação visa obter um plasma com a maior concentração de plaquetas quando comparada com a contagem basal do sangue periférico.(11) É necessário ter o cuidado minucioso para não ocorrer contaminação no procedimento durante a sua realização, permitindo a separação de plasma com elevado número de plaquetas, rico em PDGF, TGF-a (Fator de crescimento de transformação) e TGF-b, entre outros fatores.(1,8,13)
A regeneração tecidual é um processo complexo que envolve uma série de eventos biológicos. O procedimento do uso do PRP inicia-se com a aplicação das plaquetas no local lesionado, as quais se aderem ao colágeno formando um tampão plaquetário, ativando os fatores de crescimento. Cabe ressaltar que não apenas eles são ativados, mas também os macrófagos, osteoblastos, fibroblastos e células mesenquimais indiferenciadas, atuando conjuntamente na lesão.(13,14,15)
Assim, existem diversos tipos de protocolos de obtenção sugeridos na literatura para encontrar a concentração plaquetária ideal e posterior maior liberação de fatores de crescimento.(11)
O presente estudo teve como objetivo analisar os usos terapêuticos do PRP, por meio de uma revisão da literatura, de natureza qualitativa, avaliando artigos científicos eletrônicos publicados entre os anos de 2000 e 2013.
Fontes e métodos da pesquisa
Para a elaboração e desenvolvimento deste trabalho, utilizaram-se publicações da literatura nacional e internacional. Esta pesquisa caracteriza-se por uma revisão bibliográfica, sendo que esta foi realizada por meio de pesquisas em artigos científicos, monografias, dissertações de mestrado da área de Ciências da Saúde, na base de dados do Portal Periódicos Capes, Science Direct e SciELO, onde foram selecionados estudos publicados entre 2000 e 2013. Para a consecução do presente trabalho empregaram-se na pesquisa as seguintes palavras-chave: “plasma rico em plaquetas, regeneração tecidual, fatores de crescimento, platelet rich plasma, growth factors“.
PLASMA RICO EM PLAQUETAS
Fatores de crescimento e suas funções biológicas
O tecido hematopoiético é formado pelo conjunto de sangue periférico e medula óssea. O sangue é constituído por elementos figurados e plasma, o qual corresponde ao líquido intercelular, conferindo ao sangue suas propriedades líquidas. Há ainda os eritrócitos, leucócitos e plaquetas correspondentes aos elementos celulares. Após a separação do sangue, forma-se na parte superior da camada celular outra camada mais delgada, chamada de creme ou papa leucocitária (buffy coat), constituída por leucócitos e plaquetas.(9,11)
As plaquetas são pequenos fragmentos citoplasmáticos, anucleados, derivados de células da medula óssea denominadas de megacariócitos. Na formação das plaquetas, minúsculas porções do citoplasma separam-se das regiões periféricas dos megacariócitos através de grandes canais de demarcação plaquetária. Oitenta por cento das plaquetas estão sempre circulando e 20% estão concentradas no baço. As plaquetas participam ativamente no processo de reparo das feridas, sendo as primeiras células presentes no local do trauma. Um megacariócito pode originar duas a três mil plaquetas.(9)
A ação conjunta de substâncias liberadas pelas plaquetas, da coagulação sanguínea e da degradação tecidual, resulta em hemostasia. Estes acontecimentos são em grande escala controlados e dirigidos pelos fatores de crescimento específicos e quimiotáticos, possibilitando a proliferação e migração de células ativas no processo de cicatrização, sendo que estes mediadores são produzidos por diferentes tipos celulares e são classificados como citocinas, pois modulam as respostas inflamatória e imunológica do organismo.(11)
É importante abordar que é através das citocinas, que regulam a resposta imunoinflamatória do organismo, fenômeno conhecido como comunicação celular, que os fatores de crescimento têm sua função de auxiliar na regeneração dos tecidos.(14) Sendo assim, as plaquetas conseguem excretar variados tipos de fatores de crescimento,(16) isto é: fator de crescimento derivado das plaquetas (Platelet derivated growth factors – PDGF), fator transformador do crescimento b (Transforming growth factors – TGF-b), fator de crescimento semelhante à insulina (Insulin-like growth factor 1), fator de crescimento endotelial vascular (Vascular endothelial growth factor – VEGF); fator de crescimento epitelial (Epithelial growth factor – EGF); fator de angiogênese derivado da plaqueta (Platelet-derived angiogenesis factor) e fator plaquetário 4 (Platelet factor 4 – PF-4).(17)
O fator PDGF foi identificado como um agente mitogênico para células mesenquimais presentes no soro sanguíneo de macacos e camundongos, componente este presente na família relacionada aos fatores de crescimento vasculares.(18)
No trabalho em questão, o PDGF é o principal responsável pelo aparecimento no local da lesão e atua sobre a regeneração, formado por um grande número de polipeptídeos, alguns dos quais atuam nos muitos tipos celulares e outros têm alvos celulares restritos.(1,19)
As plaquetas, estruturas anucleadas que circulam no sangue periférico, possuem uma semivida de sete a dez dias e contêm no seu citoplasma estruturas (grânulos a) com uma grande concentração em proteínas. O aumento de sua produção resulta na proliferação e diferenciação celular e no aumento da produção da matriz extracelular, ajudando também na coagulação sanguínea.(4)
Outros tipos de fatores de crescimento também podem ser liberados conjuntamente com o PDGF, como o TGF-b), o PF-4 e a b-tromboglobulina, induzindo desta maneira a quimiotaxia de células no local da lesão.(1) Eles são a chave principal para regular diversos eventos celulares tais como: síntese de DNA, quimiotaxia, efeito analgésico, citodiferenciação e síntese de matriz óssea.(4)
O fator de crescimento derivado das plaquetas apresenta quatro cadeias polipeptídicas (A, B, C e D) cada qual codificada por um gene diferente.(4) Dentre estas, apresentam-se três isoformas importantes: PDGF-AA, PDGF-BB e PDGF-AB, que estão presentes também nas plaquetas humanas, sendo as cadeias A e B. Estas isoformas sugerem a formação dos dímeros ocorrendo como um processo casual, importantes para ativação de dois receptores, a e b, exercendo seus efeitos sobre as células alvo.(1) No entanto, as plaquetas são a maior fonte do heterodímero -AB, enquanto que os homodímeros -AA e -BB são encontrados em menor proporção.(1,18)
A síntese do PDGF é realizada por vários tipos celulares, incluindo fibroblastos, macrófagos, monócitos, células endoteliais, miofibroblastos e até mesmo ceratinócitos.(16)
O PDGF é muito importante pelo fato de ser o primeiro componente a estar presente no local da lesão, guiando diversos fatores para a possível regeneração do local lesionado. Quando ativo, inicia sua função atingindo as células alvo aderindo aos receptores da membrana celular e estabelecendo suas ligações, como é o caso da tirosina-quinase. Sua estrutura é dimérica, tendo dois sítios de ligação ao receptor, permitindo a união com receptores adjacentes, iniciando o processo de sinalização celular; desta forma, os receptores a ligam-se às cadeias A e B, enquanto que os receptores b ligam-se somente às cadeias B.(7) Conclui-se que, possivelmente, por esse motivo, a cadeia A tenha um papel de maior importância durante as fases iniciais do reparo que a cadeia B. Assim, o posterior aumento de suas concentrações nesses sítios acelera o processo de reparo.(1)
Tipos de fatores de crescimento e suas funções
Entre os fatores de crescimento liberados pela degranulação plaquetária e existentes no plasma rico em plaquetas podemos citar: PDGF, Fator de crescimento de transformação b (TGFb ); Fator de crescimento semelhante à insulina (IGF); Fator de crescimento epidérmico (EGF), sendo que podemos encontrá-los em vários tecidos em fase de cicatrização.(1,11) Alguns estudos específicos identificaram uma lista completa desses fatores, dentre os quais três são mais importantes, isto é, dos grânulos a plaquetários: PDGF, TGF-bs, IGF-I. Mas é necessário saber que existem outros tipos e citocinas envolvidos na regeneração e na cicatrização de feridas, os quais estão elencados na Tabela 1.
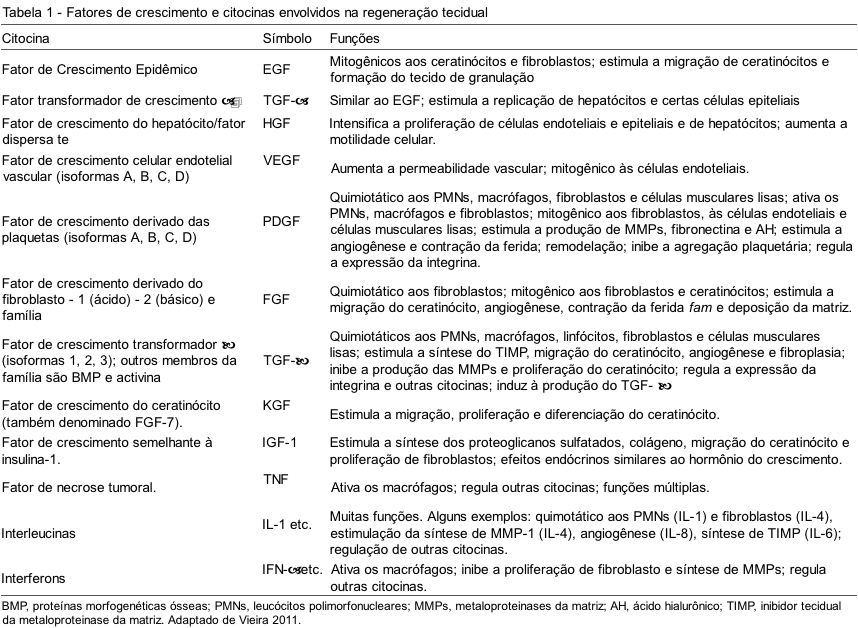
Os variados tipos de fatores de crescimento atuam em vários tipos celulares, mas alguns possuem alvos restritos. São grandes detentores de funções primordiais em nosso organismo, pois estimulam a proliferação celular, tendo efeito na locomoção, contratilidade, diferenciação e na angiogênese celular. (11)
PDGF
O fator de crescimento derivado de plaquetas (PDGF) é um importante fator de crescimento para diversas células do organismo por exercer seu efeito quimiotático. O PDGF está envolvido em quase todo o reparo tecidual, devido ao seu duplo papel de reservatório de fator de crescimento e fator de hemostasia, sendo liberado de plaquetas ativadas pela trombina ou colágeno. Seu principal efeito é servir de mediador regulando a migração, proliferação e síntese de matriz de uma variedade de células. Como abordado anteriormente, é importante neste momento ressaltar estudos científicos realizados sobre a eficiência do PDGF na reparação tecidual.(1,11)
A aplicação única da associação de PDGF/IGF-I in vivo após terapia periodontal foi capaz de promover regeneração dos tecidos periodontais.(1) O mesmo estudo foi feito em relação à dexametasona e matriz colágena no tratamento de lesões periodontais feitas por meio de histomorfometria. Logo, após quatro semanas houve resultado significativo com crescimento ósseo alveolar em áreas interdentais.(1)
IGF-S
O fator de crescimento insulínico foi inicialmente exposto na literatura por Rinderknecht e Humbel, que evidenciaram a homologia de dois polipeptídios derivados do plasma humano com a cadeia de insulina.(11)
O fator de crescimento semelhante à insulina (IGF) é encontrado nas formas de IGF1 e IGF2. São fatores secretados pelos osteoblastos e sua presença nas plaquetas age como precursora de osteoblastos. São proteínas relativamente pequenas, com massas moleculares de aproximadamente 7,5 Kd.(1)
É um fator secretado pelos osteoblastos durante a formação óssea para aumentar a osteogênese e acelerar a deposição óssea. Ele exerce diversas funções sobre o metabolismo ósseo, possui atividade quimiotática para osteoblastos e células progenitoras dos osteoblastos e fibroblastos, promovendo também a deposição de matriz óssea entre diversas outras funções. Cada um deles se adere a um receptor de membrana celular IGF específico, estimulando assim a atividade de quinase.(1)
Diversos estudos sugerem que as IGF-s, quando combinadas com outros fatores de crescimento, podem aumentar a osteogênese em processos cicatriciais. Alguns estudos observaram que o PDGF parece estar mais envolvido na proliferação celular e o IGF no aumento da síntese de produtos da matriz extracelular.(1)
TGF-b
O fator de crescimento de transformação b pode ser sintetizado pelas plaquetas, macrófagos, osteoblastos, fibroblastos e alguns outros tipos celulares. Este fator é subdividido em TGFb1 e TGFb2 e está relacionado com o reparo do tecido conjuntivo e regeneração óssea. Tem como funções mais importantes a quimiotaxia e mitogênese dos osteoblastos, estimulando a deposição de colágeno para formação óssea. Dependendo do tipo de célula afetada pode suprimir a proliferação celular e estimular a síntese da matriz extracelular.(1,20) Além disso, inibe a formação de osteoclastos e, consequentemente, a reabsorção óssea.
O TGF-b é uma proteína homodimérica produzida por uma variedade de tipos celulares. Os TGFs-b nativos são sintetizados como proteínas precursoras, que são secretadas e, então, clivadas proteoliticamente para produzir o fator de crescimento biologicamente ativo e um segundo componente latente.(1)
O TGF-b é um agente fibrinogênico potente, que estimula a quimiotaxia fibroblástica, intensifica a produção de colágeno, fibronectina e proteoglicanos e possui forte efeito anti-inflamatório. Ele inibe a degradação do colágeno pela diminuição das proteases matrizes e pelo aumento das atividades inibidoras da protease. O TGF-b está envolvido no desenvolvimento de fibrose numa variedade de condições inflamatórias crônicas, particularmente, em pulmões, rim e fígado.(1,21)
Eles têm a função de controlar a proliferação e as funções das maiorias das células dos vertebrados. São inúmeros seus efeitos nas células, dependendo do tipo de célula afetada. Eles podem tanto inibir a reabsorção óssea quanto suprimir a proliferação celular ou até mesmo atrair células por quimiotaxia.(21)
Existem cinco membros nesta família (TGF-b1 a b5), alguns são mais comuns de serem encontrados no PRP, como é o caso das TGF-b1 e TGF-b2, possuindo a função de serem ligadas ao crescimento e à cicatrização do tecido conjuntivo e também à regeneração do tecido ósseo.(1)
Como exemplo temos o TGF-b1, que atinge seu potencial quimiotático máximo a partir de 0,1 ng/mL, mas seus efeitos podem estar ligados à quantidade aplicada e ao ambiente local, podendo, desta forma, inibir ou potencializar os efeitos.(1)
Aplicações clínicas do PRP
A possibilidade de uso clínico do PRP em lesões crônicas vem sendo investigada por muitas décadas, buscando-se acelerar a recuperação do paciente sem lhe trazer riscos e nem efeitos colaterais.(1)
Os estudos que fundamentam o uso do plasma rico em plaquetas (PRP) são extremamente plausíveis e coerentes, tendo em vista que as plaquetas possuem muitas funções além da hemostasia, devido aos seus fatores de crescimento, recrutando outras células no local de lesão para realizar sua função.(1)
Borzini e Mazzucco relatam em seu artigo de revisão da literatura que, entre centenas de trabalhos publicados sobre o uso clínico dos derivados de plaquetas, muito poucos pertencem à classe dos ensaios clínicos randomizados prospectivos ou à categoria dos ensaios clínicos retrospectivos. A grande maioria dos trabalhos publicados pertence à categoria de relatos de caso ou estudos piloto. Apesar desta falta de estudos da categoria de ensaios clínicos randomizados, os autores citam que, analisando cuidadosamente os trabalhos publicados, existem fortes evidências de que o gel de plaquetas (PRP) é clinicamente efetivo.(13)
A aplicação do PRP, nos estudos publicados na literatura, varia em vários cenários clínicos envolvendo tratamentos de pele, ossos, odontológicos, cirurgias maxilofaciais, pé e perna diabética, cirurgia cardíaca e vascular, lesões timpânicas, oculares e córneas, lesões de nervos, fusão espinhal, queimaduras, cirurgia estética e lifting. Na maior parte destes estudos foram demonstrados resultados positivos e encorajadores.(13) Apesar das evidências sobre os mecanismos biológicos que sustentam a eficácia clínica do gel de plaquetas, deve-se considerar que o aspecto técnico da preparação do PRP está estreitamente relacionado a seus efeitos clínicos. Logo, a falta de padronização da técnica de preparação do PRP em diferentes estudos pode estar relacionada á falta de eficácia encontrada por alguns autores.(13)
A utilização do PRP na medicina desportiva tem aumentado devido ao seu potencial promotor da cicatrização dos músculos e tendões, e ao fato de o atleta necessitar de recuperação muito rápida e significativa em tempo curto.(1)
A Odontologia vem se destacando no uso do gel de plaquetas e tem acumulado grande experiência nesta área. O conhecimento dessa área pode servir de marco para a utilização em outras áreas, pois, como já exposto, tal procedimento não é prejudicial à saúde do paciente, pois é elaborado de forma segura com base em material fornecido pelo próprio indivíduo que será submetido ao tratamento com PRP.(17) Um estudo retrospectivo das publicações sobre o uso do PRP na Odontologia foi desenvolvido por Carlson e Roach, sendo constatado que o uso do PRP foi benéfico para o reparo tecidual envolvido.(22)
Carlson ressalta que a utilização do PRP com enxertos autógenos será um grande avanço do século XXI, prevendo um futuro com a eliminação de áreas doadoras de enxertia utilizando-se das proteínas osseomorfogenéticas.(21)
Anitua(23) aplicou PRP autógeno em alvéolos dentários e apresentou evidências macro e microscópicas positivas, como a aceleração da regeneração óssea e aumento da quantidade de osso neoformado.(8)
A triagem realizada com PDGF-BB aumenta a regeneração de úlceras crônicas, levantando-se, desta forma, a hipótese que este fator é um importante agente na regeneração de tecido mole. Estudos relatam a utilização deste mesmo fator na regeneração tecidual em pacientes com diminuição da capacidade de regeneração, como é o caso dos diabéticos.(1) É o que sugere também Tzeng et al.,(24) em proposta sobre a importância do plasma rico em plaquetas (PRP) como um adjunto para o tratamento de úlceras do pé diabético, possibilitando uma rápida melhora no local da lesão.
Jadhav,(25) em seu estudo, demonstra a efetividade quanto à concentração de plaquetas, que pode aumentar em até 338% na sua aplicação, sendo o local da lesão escolhido com o uso do PRP. Um elevado número de plaquetas, consequentemente, aumenta o número de fatores de crescimento segregados por elas, que ajudam na proliferação de células-tronco para induzir a cura e regeneração de tecidos.
O questionamento sobre a regeneração tecidual de pacientes com problemas de defeitos teciduais levou à excelência neste quesito, sendo possível a criação da engenharia tecidual, visando à geração de substitutos biológicos para restaurar a função perdida do local lesionado.(1)
Alguns estudos foram feitos também com a utilização da combinação de PDGF + IGF-I quando aplicada topicamente em lesão óssea durante cirurgia periodontal. Desta forma, uma simples aplicação foi efetiva e resultou em melhora do crescimento ósseo com preenchimento dos defeitos periodontais quando comparados à prática comum.(1)
Estudos comprovam a participação das citocinas na proliferação, no desenvolvimento e na diferenciação celular, além de outros eventos biológicos, como inflamação, regeneração e reparo, bem como a sua importância na manutenção do equilíbrio tissular.(1)
O surgimento da medicina regenerativa está viabilizando o interesse em endodontia para testar a possibilidade da polpa dentária e a regeneração da dentina. Devido aos fatores de crescimento presentes do PRP, é um ótimo coadjuvante, complemento de regeneração da dentina, baseada nas células da polpa. Estudos já foram comprovados viabilizando a possibilidade de utilização nesta área.(26)
Apesar do curto período de vida das plaquetas, provou-se histologicamente que o PRP é capaz de promover uma reparação melhorada. Portanto, o PRP utiliza ação terapêutica e inovadora de mediadores biológicos capazes de promover e potencializar eventos cicatriciais.(1)
Um estudo de caso clínico foi relatado na literatura sobre as plaquetometrias realizadas no PRP com contagem feita no sangue periférico de 44 pacientes, que apontaram concentrações de valores de aproximadamente três vezes maiores que o valor da contagem basal de plaquetas.(1)
Segundo a Sociedade Brasileira de Cirurgia Plástica,(27) o PRP é uma novidade terapêutica que consiste em aplicar as próprias proteínas de crescimento celular do paciente em diferentes áreas do corpo para favorecer seu rejuvenescimento. Os fatores de crescimento derivados das plaquetas estimulam de maneira potente a regeneração e reprodução celular por serem muito úteis em tratamentos de rejuvenescimento facial, oferecendo assim uma cútis renovada, hidratada, com boa elasticidade. É útil também como coadjuvante nas lipoenxertias faciais ou de glúteos ou como cicatrizante após cirurgias de abdômen ou mama.(28)
Para o procedimento são necessários vinte a trinta minutos, sendo realizado em ambulatório. É necessário obter uma quantidade mínima de sangue do paciente. E, mediante um processo delicado de centrifugação e seleção dos elementos sanguíneos, obtém-se um concentrado de fatores de crescimento que, no contato com a pele, agem sobre as células danificadas estimulando sua regeneração e crescimento. O PRP pode ser aplicado no rosto, no pescoço, no decote ou no dorso das mãos, como intradermoterapia, como gel facial, como máscara facial, misturado com a gordura para lipoenxertia ou no intraoperatório nas cirurgias da face, mama e abdômen.(28)
Protocolos de obtenção do PRP
O PRP é obtido a partir da coleta de sangue do paciente, por meio de um processo que utiliza o princípio da separação celular por centrifugação. O volume sanguíneo necessário depende do protocolo utilizado. Na literatura, podemos encontrar variados protocolos, dentre os quais cada um é utilizado em quantidade específica do preparado, mas, em média, de 450 mL a 500 mL de sangue. Estes protocolos são realizados em bancos de sangue ou ambientes cirúrgicos hospitalares, utilizando-se de bolsas coletoras e centrífugas de maior porte e complexidade. As bolsas para o preparo do PRP apresentam três compartimentos, que são preenchidos de acordo com as etapas realizadas.(1)
É muito importante que as condições clínicas e laboratoriais do paciente sejam favoráveis ao procedimento, por isso, é imprescindível que o indivíduo seja submetido a criteriosos exames bioquímicos, principalmente relacionados à “cascata da coagulação”, pois objetiva uma concentração máxima de plaquetas quantitativa e qualitativamente viáveis.(1)
Devem-se seguir alguns passos primordiais para o preparo desse concentrado, objetivando, desta forma, um resultado exato e preciso na sua posterior aplicação. Em primeiro lugar, deve-se coletar o sangue através de punção venosa, em local adequado e verificar a condição do acesso venoso como fatores decisivos para o êxito do procedimento, evitando desconforto desnecessário ao paciente. Busca-se sempre dar preferência para veias localizadas em membros superiores, expurgando a retirada de veias das extremidades inferiores, devido ao alto risco de flebite em veias varicosas e possibilidade de embolia pulmonar. O material da coleta deve ser preparado e colocado próximo ao paciente, na sequência do procedimento; logo após centrifugar o sangue, resultando na separação celular, objetivo da técnica, e, por fim, o preparo do plasma para aplicação no paciente,(20) conforme a Figura 1.
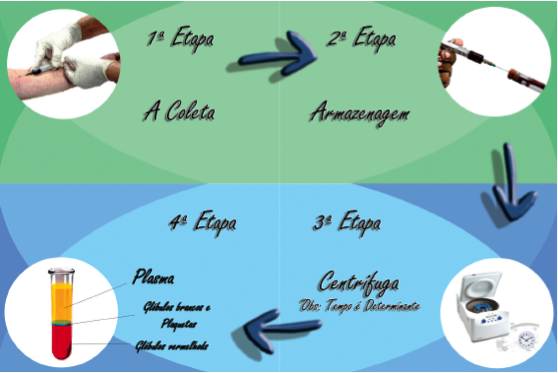
Figura 1. Sequência do procedimento
A coleta de sangue deve ser realizada antes do início da cirurgia, porque a própria cirurgia leva à ativação do mecanismo de coagulação sanguínea. Haverá um maior aporte no local cirúrgico, diminuindo sua concentração no sangue total.(1)
Cabe salientar que é de fundamental importância tranquilizar o paciente, pois a ansiedade e o temor podem desencadear um reflexo vagal, com consequente síncope e ativação do sistema nervoso simpático, produzindo vasoconstrição. Este colapso periférico é totalmente indesejável, tornando-se um fator complicador para a punção venosa.(20)
Existem variados tipos de protocolo para obtenção do PRP, mas o que se evidenciou foi que, para cada tipo de tratamento e finalidade, há um tipo de protocolo mais apropriado. Algumas técnicas não concentram quantidade de plaquetas íntegras e com ativação dos fatores de crescimento suficiente para produzir uma melhor cicatrização; talvez este evento explique a impossibilidade de efetivação de sucesso em alguns estudos científicos, como em animais.(8)
Assim, o PRP é originário do sangue total autógeno através da plasmaférese (quando há necessidade de grandes quantidades de plaquetas).(1) Caso contrário, o sangue pode ser obtido por processo de separação de diferentes densidades, pela centrifugação. Vale ressaltar que é importante o processo ser estéril e de precisão, para se conseguir um concentrado com qualidade. Durante o processo de centrifugação deve-se ter o cuidado para não provocar lise das plaquetas ou danificá-las, pois se isto ocorrer perde-se a sua atividade de estar secretando os fatores de crescimento.(8)
Outro fator relevante é o uso correto do anticoagulante, sendo normalmente indicado o citrato de sódio. Esse capta os íons de cálcio do sangue e os neutraliza formando um composto denominado quelato, impedindo a formação de coágulo. Ademais, o citrato de sódio não altera os receptores de membrana das plaquetas e, consequentemente, o processo de quelação pode ser revertido pela adição do cloreto de cálcio para formação do gel de plaquetas.(23) Importante é a escolha do material dos tubos de ensaio, os quais devem ser preferencialmente de material plástico ou com seu interior siliconizado, para evitar danos nas plaquetas durante o processo de separação celular.
Em processo ambulatorial, o volume sanguíneo coletado em tubos de ensaio é submetido ao processo de separação celular, obtendo-se duas camadas celulares. A camada superior, com uma coloração amarelada, contém o plasma rico em plaquetas, já a camada inferior, de coloração vermelha, contém os eritrócitos.(11)
Em seguida procede-se a pipetagem do plasma rico em plaquetas, descartando-se a porção inferior, que contém as hemácias. Quando se utiliza o protocolo de centrifugação dupla, o plasma rico em plaquetas pipetado volta à centrífuga e haverá uma nova separação celular: o plasma pobre em plaquetas e o concentrado de plaquetas. Uma única centrifugação não consegue concentrar adequadamente as plaquetas porque as hemácias interferem com a fina separação das plaquetas. O processo de centrifugação resulta em uma alta concentração de plaquetas, que, após a ativação, libera na “cascata” os fatores de crescimento contidos nos grânulos alfa. Adicionalmente é válido ressaltar que essa preparação, por ser autóloga, elimina o risco de transmissão de doenças ou reações imunogênicas. O concentrado de plaquetas está localizado na porção inferior do tubo e corresponde a aproximadamente 20% do volume, sendo que 80% do sobrenadante é considerado plasma pobre em plaquetas.(11)
Logo, através da contagem plaquetária é possível avaliar a eficiência do protocolo de obtenção do PRP, que, de acordo com a literatura, deve ser de três a cinco vezes maior que a contagem inicial.(23)
De acordo com Gasperini, por meio de estudo experimental com trinta pacientes determinou-se uma maior contagem plaquetária com centrifugação dupla, obtendo-se um concentrado de plaquetas aproximadamente cinco vezes maior quando comparado com a contagem inicial do sangue periférico.(6)
CONCLUSÃO
Diversos estudos da literatura demonstraram a eficácia do PRP na regeneração tecidual e cicatrização de lesões. As principais substâncias ativas biologicamente derivadas das plaquetas responsáveis pelos efeitos terapêuticos do PRP são os fatores de crescimento. A aplicação do PRP é considerada uma técnica segura, eficaz e confiável, trazendo avanços promissores quanto ao tempo de regeneração tecidual.
É de suma importância o conhecimento sobre os fatores de crescimento, tendo em vista que cada fator tem diferentes áreas de atuação, podendo não ser eficaz caso aplicada de maneira errada. O fator principal de regeneração encontrado é o PDGF, que está envolvido em quase todo processo de reparação tecidual. As etapas pré-analítica, analítica e pós-analítica são de fundamental importância para êxito da técnica.
Por todo o exposto, restou devidamente comprovado ser o PRP uma técnica inovadora, podendo ser usada em áreas multidisciplinares visando com isso à aceleração da regeneração tecidual, não apresentando contraindicações, devendo apenas haver um cuidado no manuseio do material. O uso dessa técnica pode trazer enormes benefícios para os pacientes, mas deve ainda haver maior divulgação e estudos científicos, objetivando sempre o aprimoramento da técnica.
Abstract
The platelet-rich plasma (PRP) is an innovative and advantageous that has shown significant results in various branches of medicine. The present study aimed to analyze the therapeutic uses of PRP, through a literature review, qualitative, evaluating electronic scientific articles published between 2000 and 2013. The autologous PRP prepared with the patient’s own blood, it is preferred to decrease the chance of adverse effects of treatment. It is an organic, non-toxic and non-immunoreactive, has been used to accelerate the path of surgical wound healing. Has applications in multidisciplinary areas, showing promising results especially in tissue regeneration and wound healing, viewed as a catalyst in the process of repair. Several studies in the literature show that the growth factors derived from platelets are primarily responsible for the acceleration of tissue regeneration and other therapeutic effects of PRP, and stand out among the growth factors present in PRP PDGF (growth factor, platelet-derived) universal primer considered most of the healing process. The study analyzed and discussed addresses the high potential of PRP for tissue regeneration and is considered a reliable and efficient technique.
Keywords
Platelet-rich plasma; Growth differentiation factors; Platelet activation
REFERÊNCIAS
- Pontual MAB, Magini RS. Plasma rico em plaquetas (PRP) e fatores de crescimento: das pesquisas científicas à clínica odontológica. ed. São Paulo: editora; 2004.
- Zhang N, Wu YP, Qian SJ, Teng C, Chen S, Li H. Research progress in the mechanism of effect of PRP in bone deficiency healing. Scientific World Journal. 2013 Apr 4;2013:134582.
- Vanessa FC, Marcus MG. Fator de crescimento derivado de plaquetas na implantodontia. Novas perspectivas de tratamento para reconstrução óssea. Revista Portuguesa de Estomatologia, Medicina Dentária e Cirurgia Maxilofacial. 2012 Dez; 53(1):60–66.
- Silva A. Factores de crescimento derivados das plaquetas. Rev Medic Desp in forma. 2010 Maio;1(3):27.
- Nugraha HK, Muljanti M, Hernaningsih Y, Nugraha J. Platelet rich plasma preparation protocols: a preliminary study. Indonesian Journal of Tropical and Infections Disease. 2012 Abr-Jun;3 (2):104-7.
- Gasperini G. Análise quantitativa do protocolo de obtenção do plasma rico em plaquetas do núcleo de cirurgia e traumatologia bucomaxilofacial do HU-UFSC. Florianópolis. Tese [Especialização em Cirurgia e Traumatologia Bucomaxilofacial do HU-UFSC] – Universidade Federal de Santa Catarina; 2003.
- Uebel CO. Ação do plasma rico em plaquetas e seus fatores de crescimento na cirurgia dos microimplantes capilares. Rio Grande do Sul. Tese [Doutorado em Medicina] – Pontifícia Universidade Católica do Rio Grande do Sul – PUCRS; 2006.
- Garcia RLL, Costa JRS, Pinheiro SS, Torriani MA. Plasma rico em plaquetas: uma revisão da literatura. Rev Bras Implantodont Prótese Implant. 2005;12(47/48):216-9.
- Bain BJ. Células Sanguíneas: um guia prático. 4a ed. Porto Alegre: Artmed; 2007.
- Andrade MGS, Dantas DB; Sadigurksy M. Efeitos biológicos do plasma rico em plaquetas. R Ci méd biol. 2007 Maio-Ago;6 (2):204-13.
- Macedo AP. Plasma Rico em Plaquetas: Uma análise quantitativa e qualitativa de dois protocolos de obtenção. Florianópolis Tese [Mestrado em Odontologia] – Universidade Federal de Santa Catarina – UFSC; 2004.
- Werner S, Grose R. Regulation of wound healing by growth factors and cytokines. Physiol Rev. 2003 Jul;83(3):835-70.
- Borzini P, Mazzucco I. Platelet-rich plasma (PRP) and platelet derivatives for topical therapy. What is true from the biologic view point? ISBT Science Series. 2007 Jul;2(1):272–81.
- Goldman L, Bennett JC. In: Cecil. Tratado de medicina Interna. 21ª ed. Rio de Janeiro: Guanabara Koogan; 2001.
- Andia I, Sánchez M, Maffulli N. Molecular and biological aspects of PRP therapies. Operative Techniques in Orthopaedics. 2012 Mar;22(1):3-9.
- Lins RDAU, Lucena KCR, Silveira EJD, Gomes RCB. As citocinas e o periodonto: o papel dos fatores de crescimento na saúde periodontal. Int J Dent. 2010 Jan-Mar;9(1):38-43.
- Dusse LMSA, Macedo, AP, Batschauer AP, Carvalho MG. Plasma Rico em Plaquetas (PRP) e sua aplicação em Odontologia. RBAC. 2008 Jul-Set;40(3):193-7.
- Brito IR. Influência do fator de crescimento derivado de plaquetas (pdgf) sobre o desenvolvimento in vitro de folículos pré-antrais caprinos isolados. Ceará. Tese [Mestrado em Ciências Veterinárias] – Faculdade de Veterinária Universidade Estadual do Ceará; 2010.
- Scaranto MK. Plasma rico em plaquetas. Santa Catarina. Tese [Especialização em Periodontia] – Universidade Federal de Santa Catarina Florianópolis; 2002.
- Dinato JC, Polido WD. Implantes osseointegrados: Cirurgia e prótese. 1a ed. São Paulo: Artes Médicas, 2001.
- Carlson ER. Bone grafting the jaws in the 21st century: the use of platelet-rich bone morphogenetic protein. Alpha Omegan. 2000 Ago-Set;93(3):26-30.
- Carlson NE, Roach Jr RB. Platelet-rich plasma: clinical applications in dentistry. J Am Dent Assoc. 2002 Out;10(133):1383-86.
- Anitua E, Ortiz IA. Un nuevo enfoque en la regeneracion osea. Vitoria, Spain: Puesta Al Dia Publicaciones, 2000.
- Tzeng YS, Deng SC, Wang CH, Tsai JC, Chen TM, Burnouf T. Treatment of nonhealing diabetic lower extremity ulcers with skin graft and autologous platelet gel: a case series. Biomed Res Int. 2013;2013:837620
- Jadhav G, Shah N, Logani A. Revascularization with and without platelet-rich plasma in nonvital, immature, anterior teeth: a pilot clinical study. J Endod. 2012 Dec;38(12):1581-7.
- Zhu X, Zhang C, Huang GT, Cheung GS, Dissanayaka WL, Zhu W. Transplantation of dental pulp stem cells and platelet-rich plasma for pulp regeneration. J Endod. 2012 Dec;38(12):1604-9.
- Sociedade Brasileira de Cirurgia Plástica (SBCP). Plasma rico em plaquetas. [acesso em 9 jun 2013]; Disponível em: http://www2.cirurgiaplastica.org.br/cirurgias-e-procedimentos/minimamente-invasivos/plasma-rico-em-plaquetas/
- Vieira ACQM, Medeiros LA, Palácio SB, Lyra MAM, Alves LDS, Rolim LA, Rolim Neto PJ. Fatores de crescimento: uma nova abordagem cosmecêutica para o cuidado antienvelhecimento. Rev. Bras. Farm. 2011;92(3):80-9.
Correspondência
Pâmela Aparecida da Costa
UNOESC – Videira, SC
Rua Paese, 198, Bairro Universitário
89560-000 – Videira, SC
