Tratamento da fase crônica da Doença de Chagas: revisão sistemática
Treatment of chronic phase of Chagas Disease: systematic review
Larissa Lima Mendes1
Mariana Santos da Silva1
Ana Luisa Oenning Martins2
1Graduanda. Universidade do Sul de Santa Catarina (Unisul) – Tubarão-SC, Brasil.
2Mestre. Professora- Universidade do Sul de Santa Catarina (Unisul) – Tubarão-SC, Brasil.
Instituição: Universidade do Sul de Santa Catarina (Unisul) – Tubarão-SC, Brasil.
Artigo recebido em 03/12/2015
Artigo aprovado em 14/03/2016
DOI: 10.21877/2448-3877.201600437
Resumo
A tripanossomíase americana, mais conhecida como Doença de Chagas (DC), tem por agente causal o Trypanosoma cruzi (T. cruzi). Para efeitos práticos, o tratamento da DC pressupõe uma terapêutica específica e sintomática, embora haja divergências quanto às porcentagens de cura no tratamento etiológico da DC. Objetivo: Realizar uma revisão sistemática da literatura avaliando a eficácia do tratamento durante a fase crônica da DC. Métodos: Revisão sistemática da literatura nas bases de dados: Medline, Lilacs, Cochrane e SciELO, para identificar estudos relevantes, utilizando os descritores “Chagas disease AND treatment”, “trypanossomiasis AND treatment”, “Chagas disease AND benzonidazole” e “trypanossomiasis AND benzonidazole”, onde foram avaliados os artigos publicados nos últimos dez anos. Para avaliação da qualidade metodológica dos ensaios clínicos randomizados controlados utilizou-se o escore Jadad, e para estudos observacionais, o instrumento de avaliação crítica utilizado foi a escala de avaliação Newcastle-Ottawa. Resultados: Foram encontrados 1.645 artigos nas diferentes bases de dados, sendo quatro incluídos para análise (dois ensaios clínicos randomizados e dois estudos caso controle). Conclusão: Os resultados demonstram que o tratamento etiológico da DC pode trazer benefícios durante a progressão clínica da doença e fornecer melhor prognóstico para os pacientes, particularmente quando administrados na forma indeterminada da doença.
Palavras-chave
Doença de Chagas; Trypanosoma cruzi; Antiparasitários
INTRODUção
A tripanossomíase americana, mais conhecida como Doença de Chagas (DC), tem por agente causal o Trypanosoma cruzi (T. cruzi), que provoca no homem quadros clínicos com variadas características e consequências. A cardiopatia chagásica e as dilatações de órgãos cavitários são as que se destacam por sua gravidade. Na fase crônica, as lesões cardíacas são responsáveis por elevada mortalidade.(1)
A DC é um grave problema de saúde pública na América Latina e um dos principais problemas médico-sociais brasileiros. Na América Latina, a DC é considerada, entre as doenças infecciosas e parasitárias, a de quarto maior impacto social.(2)
Para efeitos práticos, o tratamento da DC pressupõe uma terapêutica específica (contra o parasito, visando eliminá-lo) e sintomática (para atenuação dos sintomas).(3)
Somente nos anos 40 alguns compostos mostraram alguma ação contra o T. cruzi em modelos experimentais e casos agudos humanos. O principal deles foi a aminoquinolina “Bayer 7.602”, com discreta atividade parasiticida, seguindo-se um arsenical, denominado spirotrypan, muito usado nos anos 50. Estes fármacos muito tóxicos reduziam efetivamente o número de parasitas circulantes da doença na fase aguda, porém eram praticamente ineficazes na fase crônica, nunca logrando a extinção total do parasitismo, como seria necessário para a cura. A DC ganhou o estigma de incurável.(4)
No final da década de 1960, alguns experimentos indicaram a necessidade de que o tratamento fosse prolongado (até 60 dias) e ocorreu o surgimento de fármacos mais ativos, os nitrofuranos. Dentre estes, o mais efetivo foi o nifurtimox, que realmente levou à cura vários casos agudos e mesmo alguns crônicos. Mais adiante surgiu outro fármaco um pouco mais efetivo, um derivado imidazólico denominado benzonidazol.(5) No Brasil, o benzonidazol é a única droga disponível para o tratamento específico da DC. Em casos de intolerância ao benzonidazol pode-se utilizar o nifurtimox, existente na América Central.(6) O tratamento com benzonidazol exige cuidadosa atenção para adequação da dose do fármaco e para o manejo de reações colaterais que ocorrem em cerca de 30% a 40% dos pacientes, em gravidade variável.
Embora haja divergências quanto às porcentagens de cura no tratamento etiológico da DC, há consenso sobre a sua utilidade, a depender de circunstâncias, como: fase da doença, idade do paciente e condições associadas. A comprovação de cura, especialmente na fase crônica, depende de fatores como o tempo de seguimento e os exames utilizados.(7)
Na fase aguda, definida pela evidência do T. cruzi, no exame direto do sangue periférico, o tratamento deve ser realizado em todos os casos e o mais rápido possível, após confirmação diagnóstica, independente da via de transmissão. Devido à toxicidade das drogas disponíveis, não é recomendado o tratamento durante a gestação. A DC aguda é de notificação compulsória.(8)
Embora faltem evidências que garantam o sucesso da terapia nas diferentes circunstâncias, o tratamento específico pode ser instituído na forma crônica recente. Para essa finalidade considerou-se como recente o período de cinco a doze anos após a infecção inicial. Para a fase crônica de maior duração, o tratamento tem sido indicado na forma indeterminada e nas formas cardíacas leves e digestivas.(7) O papel do tratamento antiparasitário na fase crônica é discutível porque faltam maiores evidências de estudos tanto em modelos experimentais da doença como no seguimento de pacientes crônicos.(9)
Médicos e outros profissionais da saúde encontram dificuldades na elaboração de protocolos para o tratamento da DC, especialmente na fase crônica da doença. Por este motivo, reconhece-se a necessidade de revisão periódica sobre o tema, de forma a contribuir com a orientação e manejo clínico do paciente. O objetivo deste trabalho foi realizar uma revisão sistemática da literatura avaliando a eficácia do tratamento durante a fase crônica da DC.
MATERIAL E MÉTODOS
Revisões sistemáticas são baseadas em estudos primários, utilizando-se métodos previamente definidos e explícitos para identificação, seleção e avaliação crítica das pesquisas consideradas relevantes. As revisões sistemáticas, através de pesquisa bibliográfica classificatória, também contribuem como suporte teórico-prático.(10)
Foram avaliados artigos publicados nos últimos dez anos nas bases de dados Medline (PubMed), Literatura Latino-Americana e do Caribe em Ciências da Saúde (Lilacs), Cochrane Controlled Trials Data Bases e SciELO, para identificar estudos relevantes nos idiomas Inglês, Português e Espanhol.
O processo de busca utilizou os seguintes descritores: “Chagas disease AND treatment”, “trypanossomiasis AND treatment”, “Chagas disease AND benzonidazole” e “trypanossomiasis AND benzonidazole”.
Dos estudos selecionados, como critérios de inclusão foram considerados aqueles que abordassem ensaios clínicos randomizados e estudos epidemiológicos observacionais com resumo disponível. Os critérios adotados para a exclusão dos estudos compreenderam aqueles que continham: capítulos de livro, resumos de evento, editoriais, revisões sistemáticas, meta-análises, estudos transversais e artigos de opinião.
Inicialmente, para verificar se os artigos atendiam aos critérios de inclusão, os títulos de todos os estudos identificados foram avaliados por dois revisores independentes. As duplicatas foram excluídas em reunião e, para os casos em que houve discordância entre os revisores quanto à inclusão do estudo, houve avaliação por um terceiro revisor. Após estas etapas, os artigos foram selecionados conforme os resumos disponíveis e analisados pelos critérios de inclusão. Posteriormente, os estudos incluídos na revisão sistemática foram selecionados de acordo com a análise de qualidade.
Para avaliação da qualidade metodológica dos ensaios clínicos randomizados controlados utilizou-se o escore Jadad, que varia de 0 a 5 e que seleciona, para a continuidade do processo crítico, os ensaios clínicos com Jadad ³ 3.(11)
Aplicou-se um ponto para cada resposta positiva referente às questões abaixo:
– O estudo foi descrito como randomizado?
– O estudo foi descrito como duplo cego?
– Há descrição das perdas?
Aplicou-se mais um ponto para cada resposta onde houve:
– Randomização apropriada.
– Cegamento apropriado.
Retirou-se um ponto onde houve:
– Randomização inapropriada.
– Cegamento inapropriado.
Para estudos observacionais, o instrumento de avaliação crítica utilizado foi a escala de avaliação Newcastle- Ottawa.(12)
O processo de avaliação crítica com o uso dessa escala deve fornecer pontuação ³ 6. O Quadro 1 explicita a pontuação possível máxima para cada componente analisado.

O processo de avaliação da qualidade dos estudos também foi realizado por dois revisores independentes, com a participação de um terceiro revisor quando não houve consenso.
Os dados coletados dos artigos selecionados foram organizados em tabela, de acordo com autor e ano de publicação, protocolo de tratamento, nº de participantes, tempo do estudo, tempo de seguimento e escores de qualidade metodológica obtidos pelo escore de Jadad e pela escala de avaliação The Newcastle – Ottawa.
RESULTADOS
O total de artigos identificados nas bases de dados foi igual a 1.645: Medline (PubMed) – 922, Literatura Latino-Americana e do Caribe em Ciências da Saúde (Lilacs) – 498, Cochrane Controlled Trials Data Bases – 02 e SciELO – 223.
A seleção foi realizada conforme descrito a seguir:
– Publicações potencialmente elegíveis identificadas nas bases bibliográficas através dos descritores: 1.645
– Seleção dos estudos através dos títulos avaliados por dois revisores independentes: 213
– Total de estudo após a remoção de duplicidades: 84
– Seleção dos estudos através dos resumos disponíveis: 52
– Total de estudos após exclusão de resumos que não preenchiam os critérios de inclusão: 15
– Estudos incluídos na revisão sistemática após avaliação da qualidade metodológica: 04
Ao todo, foram analisados quatro artigos sobre o tratamento da DC. A Tabela 1 mostra a sua distribuição segundo o ano, a revista, nº de participantes, tempo do estudo, tempo de seguimento e escores de qualidade metodológica.
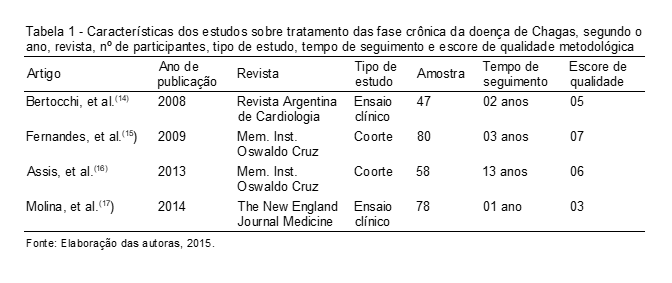
O objetivo do estudo de Bertocchi et al.(14) foi determinar o efeito da terapia com benzonidazol sobre a imunidade específica contra o T. cruzi em pacientes na fase crônica da DC. Os pacientes desse estudo foram selecionados entre os pacientes atendidos no setor de doença de chagas no Hospital Eva Peron em Buenos Aires. A infecção por T. cruzi foi determinada por imunofluorescência indireta, hemaglutinação indireta e Elisa (Enzyme-linked Immunosorbent Assay). Os participantes do estudo foram divididos em dois grupos, tratamento e controle em uma razão de 2:1, respectivamente. Os pacientes foram tratados com uma dose oral máxima de benzonidazol de 5 mg/Kg por dia por trinta dias. A frequência de linfócitos T de memória específicos contra o T. cruzi foi significativamente mais baixa no grupo tratado, 12 meses após o início da terapia. Os achados deste estudo mostraram que o benzonidazol é capaz de modular a resposta específica dos linfócitos T contra o T. cruzi.
Fernandes et al.(15) conduziram um estudo de coorte no Rio Grande do Sul com o objetivo de avaliar a eficácia do tratamento com benzonidazol em pacientes com a forma crônica indeterminada da DC. Oitenta pacientes receberam 5 mg/Kg de benzonidazol, duas vezes ao dia por sessenta dias, sendo que os mesmos foram acompanhados por um período de três anos através da realização de sorologia, hemocultura e PCR. Ao final do estudo, quatro pacientes apresentaram sorologia negativa em dois testes diferentes, evidenciando cura parasitológica.
Assis et al.(16) observaram a progressão da DC em indivíduos diagnosticados 13 anos antes em uma área endêmica do Brasil. Um grupo foi tratado com benzonidazol (5 mg/Kg por dia, por sessenta dias) e o outro grupo não foi tratado (grupo controle), sendo que a maior parte dos pacientes estava na fase indeterminada da doença. O diagnóstico de DC foi realizado por meio da imunofluorescência indireta e Elisa. Neste estudo, os dados laboratoriais e clínicos dos dois grupos foram obtidos e comparados antes do tratamento, em 1997, e 13 anos depois, em 2010. Depois de 13 anos de seguimento, a avaliação clínica mostrou que 27,6% dos pacientes tratados tiveram progressão clínica e 65,5% dos pacientes não tratados também progrediram clinicamente.
O objetivo do estudo de Molina et al.(17) foi avaliar a eficácia, segurança e efeitos colaterais do tratamento de pacientes com DC utilizando um grupo tratado com benzonidazol e outro grupo tratado com posaconazol. O diagnóstico da doença foi feito através do PCR. Os pacientes foram acompanhados por quarenta semanas após o final do tratamento. Dezesseis (61,5%) dos 26 pacientes do grupo tratado com benzonidazol apresentaram, após o período de seguimento, amostra negativa após a realização do PCR.
DISCUSSÃO
A infecção humana por T. cruzi induz uma resposta imune na maioria dos pacientes e é comum que a mesma evolua para uma infecção crônica indolente. Uma proporção de pessoas infectadas desenvolve doença crônica sintomática com dois principais padrões: doença cardíaca ou síndromes gastrintestinais.(18) O tratamento da DC baseia-se no uso de dois compostos nitroderivados, benzonidazol e nifurtimox, descobertos há mais de quatro décadas.(19) O nifurtimox foi utilizado extensivamente durante três décadas, mas atualmente não está disponível em vários países, incluindo o Brasil. A terapia com benzonidazol tem eficácia similar ao nifurtimox, com a vantagem de produzir menor incidência de efeitos colaterais.(1)
Muitos estudos sugerem que o tratamento etiológico da DC leva à negativação de resultados sorológicos e/ou na prevenção de mudanças eletrocardiográficas e clínicas relacionadas à progressão da doença.(20-22) Entretanto, outros estudos são contraditórios e indicam que, quando o tratamento é administrado durante a fase crônica, o parasito não é eliminado e a progressão da doença não é interrompida; portanto, as complicações da infecção não são prevenidas.(9,23-25)
O tratamento da infecção para o T. cruzi ainda é controverso para indivíduos na fase crônica da doença. O primeiro Guia Latino-Americano para o Diagnóstico e Tratamento da Cardiomiopatia Chagásica Crônica não faz recomendações a respeito do tratamento de indivíduos na fase indeterminada ou da fase cardíaca determinada. Na tentativa de superar essas limitações, alguns estudos prospectivos foram realizados, enquanto outros ainda estão em andamento.(26)
Muitos estudos observacionais já finalizados foram realizados com pacientes na fase crônica da DC, que é a fase na qual a maior parte dos indivíduos infectados recebe o diagnóstico.(20,21,24,25,27-31) Nesta revisão sistemática, após exclusão baseada na avaliação da qualidade metodológica, foram selecionados quatro artigos, sendo dois ensaios clínicos e dois estudos de coorte, todos conduzidos com pacientes na fase crônica da DC.
A pesquisa de Bertocchi et al.,(14) realizada em 2008, avaliou o impacto da terapia com benzonidazol no estágio crônico da infecção por T. cruzi na resposta imune celular específica para este parasito. Os resultados mostraram que a terapia etiologicamente direcionada contra o T. cruzi pode modular a resposta das células T de memória específicas do parasito. No estudo, 44% dos pacientes tratados com benzonidazol mostraram resposta imunológica negativa com relação aos linfócitos T associados à infecção por T. cruzi. Destes, 36% apresentaram sorologia negativa para T. cruzi dois anos após o tratamento.(14) Alguns autores sustentam a ideia de que a infecção crônica por T. cruzi levaria à exaustão do sistema imune, como consequência da persistência do antígeno no organismo. Isso pode afetar a capacidade do sistema imune em controlar a infecção, levando à progressão da doença.(32) Uma melhor compreensão da cinética da parasitemia e da resposta imunológica após o tratamento pode ajudar a desenvolver algoritmos de manejo clínico para infecção chagásica crônica.
No estudo de Fernandes et al.,(15) durante o período de seguimento, métodos sorológicos, parasitológicos e PCR foram utilizados para avaliar a resposta ao tratamento com o benzonidazol. Houve 100% de concordância entre os ensaios Elisa e IFI (imunofluorescência indireta). No entanto, títulos distintos de anticorpos foram encontrados nestes pacientes, possivelmente como consequência de uma grande heterogeneidade genética do parasito, o que poderia influenciar na resposta imune dos indivíduos parasitados.(33,34) Neste estudo, nenhum dos oitenta pacientes tratados apresentou hemocultura positiva após os três anos de acompanhamento. Um exame parasitológico negativo por si só não representa sucesso no tratamento, no entanto, sua positividade após a quimioterapia representa o fracasso terapêutico.(15) A interpretação dos resultados de PCR no diagnóstico da DC é controversa, pois um resultado positivo pode refletir a detecção do DNA do parasito ou ainda a presença do parasito intacto ou lisado.(35) O estudo de Fernandes et al.(15) mostrou que 5% dos pacientes submetidos ao tratamento com benzonidazol foram curados após três anos de seguimento, já que apresentaram PCR negativo e sorologia negativa para o T. cruzi.
Os resultados de Assis et al. (2013)(16) demonstraram que tanto os pacientes tratados quanto os não tratados apresentaram sorologia positiva para o T. cruzi 13 anos após o início do estudo. Entretanto, os pacientes tratados apresentaram menores títulos sorológicos do que os não tradados, o que também foi verificado por outros autores.(15,21,36) Após o período de seguimento, Assis et al. (2013)(16) demonstraram que 27,6% dos pacientes tratados demonstraram progressão clínica contra 65,5% dos pacientes não tratados. Tais resultados indicam que o tratamento etiológico atrasa a progressão clínica da doença e melhora o prognóstico do paciente, mesmo em casos nos quais a cura parasitológica não é observada. Neste estudo, também foram incluídos pacientes com as formas cardíaca e digestiva, entretanto, devido ao baixo número dos mesmos, não foi possível definir uma interpretação definitiva acerca do tratamento etiológico nesta fase da doença.
No estudo de Molina et al., (2014)(17) o benzonidazol apresentou atividade tripanocida sustentada. Dos pacientes tratados, 94% apresentaram PCR negativo até o final do seguimento. Neste mesmo estudo, alguns pacientes tiveram que descontinuar o tratamento com o benzonidazol por conta de efeitos adversos (dermatite alérgica). Embora os resultados deste autor pareçam indicar um efeito benéfico do tratamento com benzonidazol, uma metanálise de estudos concluiu que a eficácia desta droga no estágio crônico da DC é duvidosa.(37)
Estudos de revisão sistemática são importantes para analisar pesquisas desenvolvidas em uma determinada área do conhecimento, facilitando o acesso aos pesquisadores que precisam de uma revisão rápida, além de direcionar estudos futuros. A presente revisão apresenta como limitação o fato de não terem sido pesquisadas bases de dados diferentes da PubMed, SciELO, Lilacs e Cochrane, o que pode ter reduzido a chance de identificação de estudos importantes. Além disso, diferenças na forma como os estudos foram realizados podem ter trazido impacto para os resultados obtidos. Cada estudo teve seu próprio critério de elegibilidade e foi conduzido em diferentes contextos.
Os resultados verificados nesta revisão sistemática sugerem um efeito tripanocida do benzonidazol em longo prazo em pacientes na fase crônica da DC. O tratamento etiológico da DC pode reduzir a progressão clínica da doença e fornecer melhor prognóstico para os pacientes, particularmente quando administrados na forma indeterminada da doença. Mais pesquisas são necessárias para explorar as potenciais fontes de heterogeneidade dos estudos e para conduzir uma análise confiável dos resultados.
Abstract
The American trypanosomiasis, known as Chagas’ disease (CD), is the causative agent Trypanosoma cruzi (T. cruzi). For practical purposes, treatment of DC requires a specific and symptomatic therapy, although there is disagreement about the cure rates in the etiological treatment of CD. Objective: To perform a systematic review of the literature evaluating the effectiveness of treatment during the chronic phase of CD. Methods: Systematic Review of the literature in databases: Medline, Lilacs, Cochrane and SciELO, to identify relevant studies using the keywords “Chagas disease AND treatment”, “trypanossomiasis AND treatment”, “Chagas disease benznidazole AND” and “trypanossomiasis AND benznidazole” that evaluated the articles published in the last 10 years. To assess the methodological quality of randomized controlled trials used the Jadad score and observational studies, the critical assessment instrument was the rating scale Newcastle-Ottawa. Results: We found 1.645 articles in different databases, four included for analysis (two randomized clinical trials and two case-control study). Conclusion: The results demonstrate that the etiological treatment of DC may benefit during the clinical progression of the disease and provide better prognosis for patients, particularly when administered in the indeterminate form of the disease.
Keywords
Chagas disease; Trypanosoma cruzi; Antiparasitic agents
REFERÊNCIAS
- Marin-Neto J Antonio, Rassi Jr Anis, Avezum Jr Alvaro, Mattos Antonio C, Rassi Anis. The BENEFIT trial: testing the hypothesis that trypanocidal therapy is beneficial for patients with chronic Chagas heart disease. Mem. Inst. Oswaldo Cruz [Internet]. 2009 Julho [cited 2015 Oct 20]; 104 (Suppl 1):319-24.
- Dias JCP. Doença de Chagas, ambiente, participação e Estado. Cad Saúde. Pública. 2001;17:165-9.
- Dias JCP. O tratamento específico da doença de Chagas [Internet]. 10ª Conferencia nacional de saúde, 1999; Acesso em 2015 Mai 04. Disponível em: www.datasus.gov.br/ cns.
- Conferência Nacional de Saúde Online. O tratamento específico da doença de chagas [Internet]. Acesso em 2015 Mai 14. Disponível em: http://www.datasus.gov.br/cns/ temas/tribuna/tratamento.htm.
- Araújo MS, Martins-Filho OA, Pereira ME, Brener Z. A combination of benznidazole and ketoconazole enhances efficacy of chemotherapy of experimental Chagas’ disease. J Antimicrob Chemother. 2000;45(6):819-24.
- Ministério da Saúde (Brasil). Consenso Brasileiro em Doença de Chagas. Rev Soc Bras Med Trop. 2005;38 (Supl III).
- Ministério da Saúde (Brasil). Secretaria Nacional de Vigilância em Saúde. Guia de vigilância epidemiológica. 6a. ed. Brasília (DF); 2005.
- Ministério da Saúde (Brasil). Secretaria de Vigilância em Saúde. Programa Nacional de Controle da Doença de Chagas. Vigilância em saúde: doença de Chagas. Brasília, 2009. (Série A. Normas e Manuais Técnicos – Cadernos de Atenção Básica, n. 22). No prelo.
- Ianni BR, Mady C. Terapêutica da forma crônica da Doença de Chagas. É eficaz o tratamento etiológico? Arq Bras Cardiol. 1998;70(1): 59-61.
- Mulrow CD. Rationale for systematic reviews. BMJ. 1994;309 (6954):597-9.
- Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, McQuay HJ. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996; 17(1):1-12.
- The Newcastle-Ottawa Scale (NOS) for Assessing the Quality of Nonrandomized Studies in Meta-Analysis. [Acesso em: 2015, Jul 02]. Disponível em: http.www.iri.ca.
- Bernardo WM. A revisão sistemática na prática clínica baseada em evidência. Femina. 2008;10:42:36.
- Bertocchi GL, et al. Immunological Assessment of Benznidazole Therapy in Chronic Chagas Disease. Rev Argent Cardiol 76 (2008): 260-5.
- Fernandes CD, Tiecher FM, Balbinot MM, Liarte DB, Scholl D, Steindel M, Romanha A. Efficacy of benznidazole treatment for asymptomatic chagasic patients from state of Rio Grande do Sul evaluated during a three years follow-up. Mem Inst Oswaldo Cruz. 2009;104(1):27-32.
- Machado-de-Assis GF, Diniz GA, Montoya RA, Dias JC, Coura JR, Machado-Coelho GL, et al. A serological, parasitological and clinical evaluation of untreated Chagas disease patients and those treated with benznidazole before and thirteen years after intervention. Mem Inst Oswaldo Cruz [Internet]. 2013 Nov [cited 2015 Nov 03] ;108(7): 873-80.
- Molina I, Gómez i Prat J, Salvador F, Treviño B, Sulleiro E, Serre N, et al. Randomized trial of posaconazole and benznidazole for chronic Chagas’ disease. N Engl J Med. 2014;370(20):1899-908.
- Reyes PA, Vallejo M. Trypanocidal drugs for late stage, symptomatic Chagas disease (Trypanosoma cruzi infection). Cochrane Database Syst Rev. 2005;(4):CD004102.
- Viotti R, Vigliano C, Lococo B, Alvarez MG, Petti M, Bertocchi G, Armenti A. Side effects of benznidazole as treatment in chronic Chagas disease: fears and realities. Expert Rev Anti Infect Ther. 2009;7(2):157-63.
- Gallerano RR, Sosa RR. Interventional study in the natural evolution of Chagas disease. Evaluation of specific antiparasitic treatment. Retrospective-prospective study of antiparasitic therapy. Rev Fac Cien Med Univ Nac Cordoba. 2000;57(2):135-62. [Article in Spanish]
- Fabbro DL, Streiger ML, Arias ED, Bizai ML, del Barco M, Amicone NA. Trypanocide treatment among adults with chronic Chagas disease living in Santa Fe city (Argentina), over a mean follow-up of 21 years: parasitological, serological and clinical evolution. Rev Soc Bras Med Trop 2007;40:1-10.
- de Lana M, Lopes LA, Martins HR, Bahia MT, Machado-de-Assis GF, Wendling AP, et al. Clinical and laboratory status of patients with chronic Chagas disease living in a vector-controlled area in Minas Gerais, Brazil, before and nine years after aetiological treatment. Mem Inst Oswaldo Cruz. 2009;104:1139-47.
- Amato Neto V. Terapêutica da forma crônica da doença de Chagas. Tratamento específico da infecção pelo Trypanosoma cruzi. Arq Bras Cardiol. 1998;70: 63-4.
- Braga MS, Lauria-Pires L, Argañaraz ER, Nascimento RJ, Teixeira AR. Persistent infections in chronic Chagas’ disease patients treated with anti-Trypanosoma cruzi nitroderivatives. Rev Inst Med Trop Sao Paulo 2000;42:157-61.
- Lauria-Pires L, Braga MS, Vexenat AC, Nitz N, Simões-Barbosa A, Tinoco DL, Teixeira AR. Progressive chronic Chagas heart disease ten years after treatment with anti-Trypanosoma cruzi nitroderivatives. Am J Trop Med Hyg. 2000;63(3-4):111-8.
- Villar JC, Perez JG, Cortes OL, Riarte A, Pepper M, Marin-Neto JA, Guyatt GH. Trypanocidal drugs for chronic asymptomatic Trypanosoma cruzi infection. Cochrane Database Syst Rev. 2014;(5):CD003463.
- Sosa Estani S, Segura EL, Ruiz AM, Velazquez E, Porcel BM, Yampotis C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. Am J Trop Med Hyg. 1998;59(4):526-9.
- de Andrade AL, Zicker F, de Oliveira RM, Almeida Silva S, Luquetti A, Travassos LR, et al. Randomised trial of efficacy of benznidazole in treatment of early Trypanosoma cruzi infection. Lancet. 1996;348(9039):1407-13.
- Viotti R, Vigliano C, Lococo B, Bertocchi G, Petti M, Alvarez MG, et al. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment: a nonrandomized trial. Ann Intern Med. 2006;144(10):724-34.
- Coura JR, de Abreu LL, Willcox HP, Petana W. Comparative controlled study on the use of benznidazole, nifurtimox and placebo, in the chronic form of Chagas’ disease, in a field area with interrupted transmission. I. Preliminary evaluation. Rev Soc Bras Med Trop. 1997;30(2):139-44.[Article in Portuguese]
- de Castro AM, Luquetti AO, Rassi A, Chiari E, Galvão LM. Detection of parasitemia profiles by blood culture after treatment of human chronic Trypanosoma cruzi infection. Parasitol Res. 2006;99(4): 379-83.
- Albareda MC, Laucella SA, Alvarez MG, Armenti AH, Bertochi G, Tarleton RL, Postan M. Trypanosoma cruzi modulates the profile of memory CD8+ T cells in chronic Chagas’ disease patients. Int Immunol. 2006;18(3):465-71.
- Di Noia JM, Buscaglia CA, Marchi CR, Almeida IC, Frasch AC. A Trypanosoma cruzi small surface molecule provides the first immunological evidence that Chagas’ disease is due to single parasite lineage. J Exp Med. 2002;195(4):401-13.
- Buscaglia CA, Di Noia J. Trypanosoma cruzi clonal diversity and the epidemiology of Chagas’ disease. Microb Infec. 2003;5:419-27.
- Britto C, Silveira C, Cardoso MA, Marques P, Luquetti A, Macêdo V, Fernandes O. Parasite persistence in treated chagasic patients revealed by xenodiagnosis and polymerase chain reaction. Mem Inst Oswaldo Cruz. 2001;96(6):823-6.
- Viotti R, Vigliano C, Álvarez MG, Lococo B, Petti M, Bertocchi G, et al. Impact of aetiological treatment on conventional and multiplex serology in chronic Chagas disease. PLoS Negl Trop Dis. 2011; 5(9):e1314
- Pérez-Molina JA, Pérez-Ayala A, Moreno S, Fernández-González MC, Zamora J, López-Velez R. Use of benznidazole to treat chronic Chagas’ disease: a systematic review with a meta-analysis. J Antimicrob Chemother 2009;64(6):1139-47.
Correspondência
Ana Luisa Oenning Martins
Universidade do Sul de Santa Catarina
Avenida José Acácio Moreira, 787, Dehon
88704-900 – Tubarão-SC, Brasil
